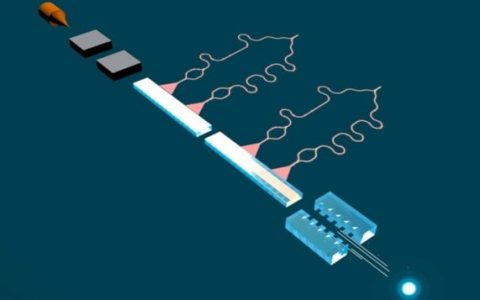
双管Nano移液器信息图显示了单细胞的Nano活检和随后的样品分析。 (由利兹大学提供。图片由 Somersault1824 设计)
双管Nano移液器信息图显示了单细胞的Nano活检和随后的样品分析。 (由利兹大学提供。图片由 Somersault1824 设计)
胶质母细胞瘤(GBM)是最致命、最具侵袭性的脑癌。 几乎所有肿瘤在治疗后都会复发,因为随着时间的推移,存活的细胞会转变为更有弹性的形式以抵抗进一步的治疗。 为了应对这一挑战,利兹大学的科学家设计了一种新型双管Nano移液器,并用它来研究单个活 GBM 细胞响应治疗而变化的轨迹。
Nano移液器由两个Nano针组成,可以同时将外源分子注射到细胞中并从细胞中提取细胞质样本。 Nano移液器集成到扫描离子电导显微镜 (SICM) 中,对培养物中的活细胞进行Nano活检。 与通常破坏细胞的现有单细胞研究技术不同,Nano移液器可以对活细胞进行重复活检而不杀死它,从而能够对单个细胞随时间的行为进行纵向研究。
研究人员在《科学进展》上撰文解释说,SICM 的工作原理是测量插入玻璃Nano移液管的电极和浸入含有细胞的电解溶液中的参比电极之间的离子电流。 在两个电极之间施加电压后,当离子电流流过Nano移液器尖端的Nano孔时,进行Nano活检。 在他们的双筒Nano移液器中,其中一个筒充当电化学注射器来进行细胞质提取; 第二个包含电解质水溶液,可为Nano活检之前的精确定位和Nano注射提供稳定的离子流。
该半自动化平台能够提取飞升成交量的细胞质并同时注射到单个细胞中。 该平台使用反馈控制(当Nano移液器接近样品时离子电流下跌)提供Nano移液器的自动定位,而特定电流特征的检测表明单个细胞的膜成功穿透。
纵向研究
作为该平台能力的概念验证,研究人员对 GBM 细胞(及其后代)进行了纵向Nano活检,分析了 72 小时内的基因表达变化。 他们在治疗前、放疗和化疗期间以及治疗后进行了Nano活检。
联合首席研究员 Lucy Stead 和 Paolo Actis 写道:“我们的方法稳健且可重复,允许膜渗透和Nano注射跨越具有不同机械特性的不同细胞类型。” “Nano注射的平均成功率为 0.89 ± 0.07。 然后提取细胞内 mRNA。”
研究人员研究了 GBM 细胞对 2 Gy 辐射和 30 µM 替莫唑胺标准治疗的反应。 他们在 72 小时内目视跟踪单个细胞及其子代,在此时间范围内 98% 的细胞保留在显微镜的视野中——这是进行纵向分析的一个重要因素。
 适应和分裂在化疗和放疗中存活并分裂的 GBM 细胞的荧光图像。 (由法比奥·马库乔提供)
适应和分裂在化疗和放疗中存活并分裂的 GBM 细胞的荧光图像。 (由法比奥·马库乔提供)
第一天,研究人员进行活组织检查,注射荧光染料并对每个细胞进行成像。 第二天,一半的细胞接受了放疗和化疗,而其他细胞则作为对照。 所有细胞在第 2 天和第 3 天进行成像,并在第 4 天再次进行活检和注射。
在接受第一天Nano活检的细胞中,处理过的细胞和未处理过的细胞之间的存活率相似,并且两组的细胞分裂率相当。 72 小时后,未处理的对照(未活检)细胞中有 63% 存活,而处理后的活检细胞存活率为 25%。 无论进行何种治疗,第一天细胞亚型的后续死亡率没有差异。 然而,与处理过的细胞相比,未处理的细胞随着时间的推移改变亚型或产生具有不同亚型的后代的比例要大得多。
研究人员写道:“这表明,在三天的时间内,未经处理的细胞比处理过的细胞更具可塑性。” “配对第 1 天和纵向样本的细胞表型评分显示,经过处理的细胞在治疗期间往往保持相同的表型,而未经处理的细胞更有可能在 72 小时内切换转录状态,这表明治疗要么诱导或选择高转录稳定性在这个已建立的 GBM 细胞系中。”
“这是一个重大突破,”斯特德说。 “这是我们第一次拥有一种技术,可以真正监控治疗后发生的变化,而不是仅仅假设它们。 这种技术将提供我们以前从未有过的一层理解。 这种新的理解和洞察将导致我们的军械库中出现对抗所有类型癌症的新武器。”
该团队坚信,这些多功能Nano探针能够以最小的破坏进入细胞内环境,有可能“彻底改变分子诊断、基因和细胞疗法”。
“我们未来的工作将中心化于提高该技术的吞吐量,以便可以分析更多的细胞,”英联告诉《物理世界》。 “我们正在努力改进分析从细胞中提取的 RNA 的方案,以便收集更多的生物信息。 我们也非常热衷于研究基于患者来源的细胞和类器官的更先进的脑癌生物模型。”
资讯来源:由a0资讯编译自THECOINREPUBLIC。版权归作者A0资讯所有,未经许可,不得转载